
Metagenomics(元基因組學,或者宏基因組學),是由 Handelman等1998年最先提出的一種直接對微生物群體中包含的全部基因組信息進行研究的手段。宏基因組測序是對特定環境樣品中的微生物群落基因組進行高通量測序,以分析微生物群體基因組成多樣性與豐度,探求微生物與環境以及宿主之間的關系,發掘和研究新的、具有特定功能的基因。它規避了對樣品中的微生物進行分離培養的過程,提供了一種對不可分離培養的微生物進行研究的途徑,更真實的反應樣本中微生物組成、互作情況、系統進化等,同時在分子水平對其代謝通路、基因功能進行研究。
應用方向
1. 健康和疾病人群細菌分類鑒定、屬菌豐度統計、差異菌群Biomarker 篩選
2. 挖掘健康和疾病人群微生物群落中的功能基因等作為Biomarker
3. 疾病與微生物菌群、菌落中的功能基因關系的研究
實驗方案
測序平臺與方式:Illumina平臺 PE150
數據量:大于6G clean data
技術優勢
1. 單次測序產生至少6G數據量,有利于發現特異物種信息,深度挖掘基因資源;
2. 無需分離培養微生物,對微生物群落多樣性和功能基因等宏觀特征進行研究,能更有效、準確的反應出微生物的真實狀態;
3. 相較于16S rDNA測序,宏基因組不僅可以對細菌分類進行分析,還能進行基因和功能層面的深入研究;
4. 16S rDNA測序一般注釋到屬水平,而宏基因組能鑒定到種水平甚至菌株水平,并且16S測序只擴增了高變區的片段,宏基因組是將微生物基因組打斷并拼接組裝成較長的序列,可以發現更多低豐度物種信息,構建不同物種之間的代謝網絡途徑,因此在鑒定物種過程中具有更高的優勢;
技術流程

圖1 宏基因組測序實驗流程
數據分析
3.1數據質控
3.2 Metagenome組裝
3.3 基因預測
3.4 物種注釋
3.5 功能注釋
3.6物種和功能分析
3.7抗性基因分析:獲得抗性基因豐度分布情況以及這些抗性基因的物種歸屬和抗性機制
3.8其他高級分析:如CCA/RDA分析,腸型分析,拷貝數變異(CNV)分析,CAG/MLG分析,病原與宿主互作數據庫(PHI)注釋,分泌蛋白預測, Ⅲ型分泌系統效應蛋白預測,細菌致病菌毒力因子(VFDB)注釋,轉移元件分析(MGE)等;同時,結合環境因子、病理指標或特殊表型進行深入關聯研究,能夠為進一步深入研究和利用樣品的物種和功能提供理論依據。
送樣建議
樣本來源:人、大鼠和小鼠(其它樣本類型請咨詢)
人糞便樣本:>2g/樣;動物糞便>0.5g/樣
腸道內容物樣本:200mg/樣
腸道組織樣本:>1g/樣品,塊狀物需要黃豆樣大小 1~2 粒/樣
運輸條件:干冰運送
結果展示
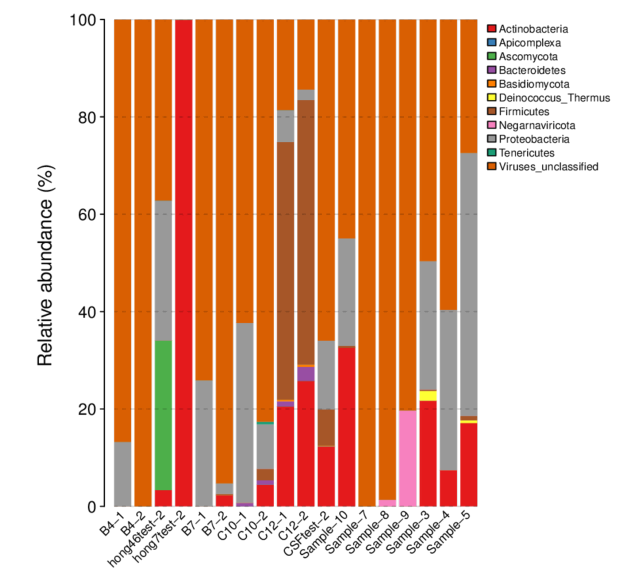
圖2 各樣品Phylum水平的物種相對豐度柱形圖
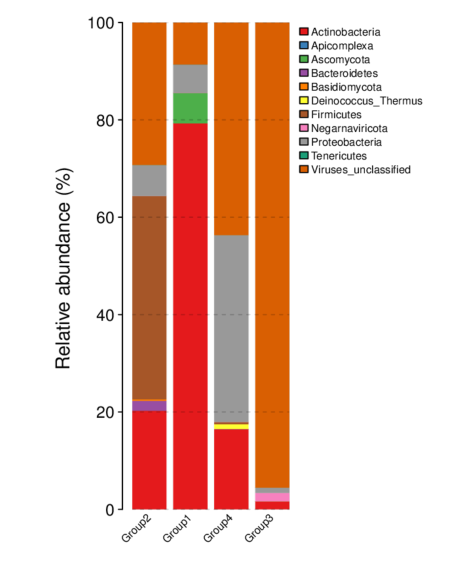
圖3 各組Phylum水平的物種相對豐度柱形圖
(從不同分類層級的相對豐度表出發,并將豐度 < 0.5% 的物種設置為 Others,繪制出各樣品對應的物種注釋結果在不同分類層級上的相對豐度柱形圖)
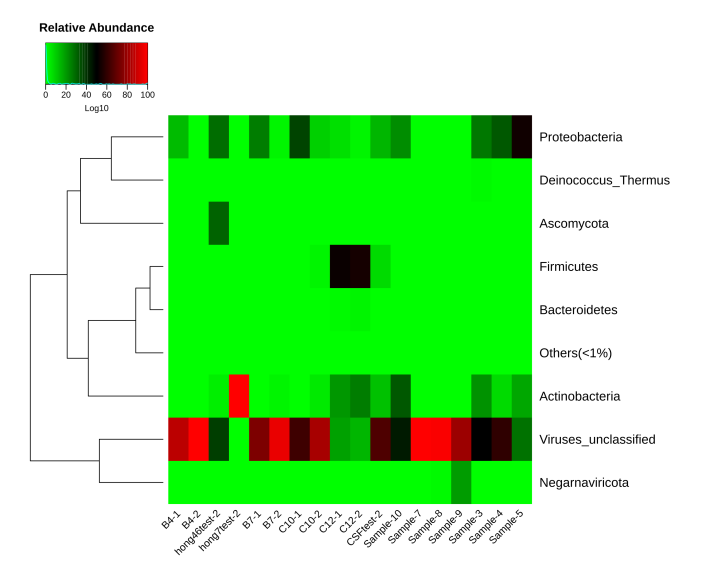
圖4 各樣品Phylum水平的物種相對豐度熱圖

圖5 各組Phylum水平的物種相對豐度熱圖
(從不同分類層級的相對豐度表出發,每個樣品中的豐度信息繪制熱圖,并從物種層面進行聚類,便于結果展示和信息發現,從而找出樣品中聚集較多的物種)

圖6 基于LDA score篩選的biomarker

圖7 特征物種的柱狀環形圖
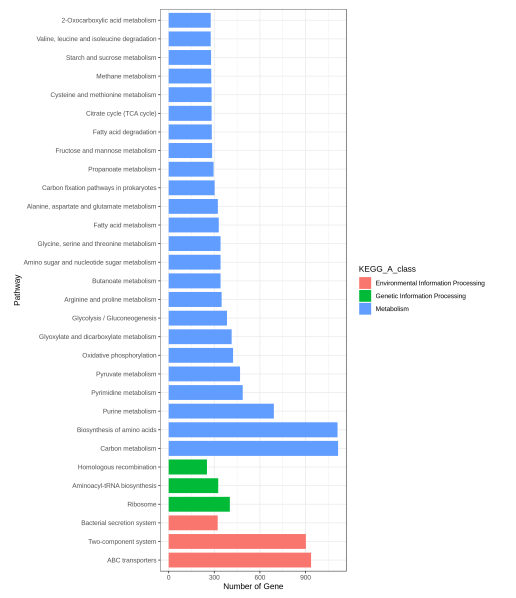
圖8 KEGG注釋基因數目統計圖
案例分析 :利用宏基因組新一代測序技術洞察肺結核患者獨特的肺菌群圖譜
Insights into the Unique Lung Microbiota Profile of Pulmonary Tuberculosis Patients Using Metagenomic Next-Generation Sequencing[1]

研究方案:為探究與肺結核相關的微生物群分布情況,并研究抗結核治療期間的縱向變化,研究者采集8 名健康人(HCG)、12 名未治療的肺結核患者(UTG)、15 名已治療的肺結核患者(TTG)、11 名治愈的肺結核患者(CTG)和 7 名肺癌患者(LCG)的支氣管肺泡灌洗液(BALF)樣本,并在健康對照組中采集咽拭子。利用metagenomic sequencing分析比較指定組中微生物群的差異,對結核病患者的肺部微生物群進行了表征,并評估抗結核治療對肺微生物群的影響。
研究結果:本研究對所有隊列數據進行了主坐標(CAP)分析,發現在屬和種水平上,咽拭子和 BALF 樣本之間的微生物群組成存在明顯分離。為了研究上呼吸道和下呼吸道微生物群的差異,研究者比較了健康對照的咽拭子和 BALF 間的微生物群,發現咽拭子中的ACE指數和Chao1指數在種和屬水平上均遠高于BALF,香農指數在種水平上顯著高于BALF,但在屬水平上無顯著差異,而辛普森指數在種或屬水平上這兩組樣本之間沒有顯著差異。主坐標分析 (PCoA) 顯示,在種和屬水平上,BALF 簇與咽拭子簇明顯分離,表明上呼吸道和下呼吸道之間的微生物群組成不同。進一步研究者分析了咽拭子和 BALF 間相對豐度top 30的物種,發現咽拭子和BALF中top30的細菌分別占細菌總數的61.58%和84.03%,其中,Klebsiella pneumoniae、Staphylococcus aureus、Pasteurella multocida是三組中的優勢物種。為了研究長期抗結核治療后治愈的結核病患者的肺微生物群的變化機制,研究者比較了HCG和CTG之間的微生物組成,發現2組的多樣性指數沒有顯著差異,通過LEfSe分析(LDA SCORE>2.0)也并未發現兩組之間有存在差異的物種,結果表明治愈的結核病患者表現出與健康人相似的肺微生物群結構和組成。進一步研究發現CTG比HCG顯示出更多的多樣性和豐富的ARGs,并在 cooccurrence network中顯示CTG中細菌和ARGs的連接要比HCG中的復雜。結果表明,肺結核患者區別于健康個體和肺癌患者表現出獨特的微生物組成,抗結核病治療增加了肺微生物群的α多樣性并影響了β多樣性,加速了ARGs的富集。通過對肺部微生物群進行分析比較有助于更好地了解肺結核的發病機制。

圖9 所有樣本中的菌群情況
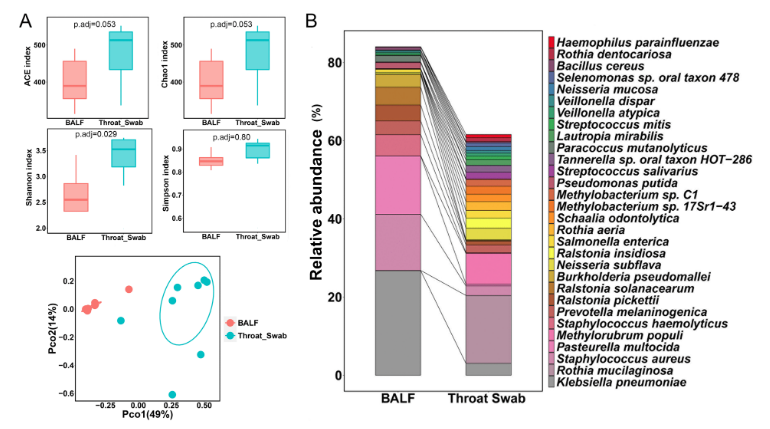
圖10 來自健康對照組的咽拭子和BALF樣本之間的菌群分布有顯著差異
參考文獻:Xiao G, Cai Z, Guo Q, et al. Insights into the Unique Lung Microbiota Profile of Pulmonary Tuberculosis Patients Using Metagenomic Next-Generation Sequencing[J]. Microbiology spectrum, 2022, 10(1): e01901-21.