
miRNA是一類高度保守的小RNA分子,它可以參與基因表達與調(diào)控、RNA的加工與剪切、蛋白質翻譯、遺傳“入侵”抑制、配子發(fā)生等重要生物學過程,是生命活動中必不可少的調(diào)控因子。miRNA測序技術采用膠分離技術,收集樣本中18-30nt的RNA片段,利用高通量測序技術對樣本中所有small RNA家族進行測序和表達定量,從而解析miRNA 、siRNA 、piRNA 其它非編碼RNA等序列,并預測新的小RNA及其靶基因。
1、實驗方案
測序策略:Illumina 平臺 SE50
數(shù)據(jù)量:10M clean reads
2、技術優(yōu)勢
(1)通量高:一次測序得到上千萬條序列;
(2)分辨率高:可以檢測小RNA單個堿基的差異;
(3)精準度高:從幾個到幾十萬個拷貝精確計數(shù);
(4)可重復性好:深度測序保證了抽樣隨機性,重復性好,無需重復實驗;
(5)檢測范圍廣:既能鑒定已知小RNA,又能發(fā)現(xiàn)新的小RNA。
3、信息分析
3.1 標準信息分析
(1)按標準流程進行數(shù)據(jù)整理及數(shù)據(jù)質量評估;
(2)樣品間的公共序列和特異序列分析;
(3)小RNA與參考基因組比對分析;
(4)按照優(yōu)先級將小RNA進行分類注釋
(5)Novel Small RNA預測;
(6)樣本間miRNA差異表達分析;
(7)已知miRNA的家族分析;
(8)已知miRNA差異分析(≥2個樣本)和聚類分析(≥3個樣本);
(9)已知miRNA和novel miRNA的靶基因預測;
(10)已知miRNA和novel miRNA的靶基因GO注釋和KEGG通路分析;
(11)novel miRNA差異分析(≥2個樣本)和聚類分析(≥3個樣本);
(12)差異miRNA靶基因預測;
(13)已知miRNA的堿基編輯分析;
3.2 高級信息分析
(1)snoRNA注釋
(2)piRNA注釋
(3)mir2disease注釋
4、技術流程

5、案例分析
案例(1)小鼠早期胚胎發(fā)育過程中小RNA的動態(tài)變化及其生物學功能
該研究利用優(yōu)化的方法系統(tǒng)解析了小鼠卵子到受精后8細胞胚胎發(fā)育過程中的小RNA動態(tài)變化,發(fā)現(xiàn)小鼠卵子和早期胚胎主要包含三類小RNA:endo-siRNA、piRNA和miRNA。受精卵中的這三類小RNA絕大多數(shù)來源于卵子,由精子帶入卵子的小RNA不足幾百分之一。隨著胚胎的發(fā)育,母源endo-siRNA和piRNA逐漸被緩慢降解。而母源miRNA的降解較快,主要發(fā)生在胚胎2細胞期前后。合子中新表達的miRNA最早出現(xiàn)在受精卵第一次分裂前,并隨著胚胎的發(fā)育持續(xù)被激活表達,特別是進化保守的miRNA的表達量迅速上升。研究人員進一步結合小鼠早期胚胎發(fā)育的轉錄組數(shù)據(jù)進行分析,發(fā)現(xiàn)miRNA在卵子到胚胎2細胞期中幾乎沒有降解靶基因mRNA的功能,而在4-8細胞期中miRNA降解靶基因mRNA的功能開始逐步恢復,并對合子激活表達的基因有明顯的靶向抑制作用。以上研究不僅揭示了小鼠早期胚胎發(fā)育中miRNA的表達和降解規(guī)律,還發(fā)現(xiàn)了miRNA對靶基因的調(diào)控活性隨著胚胎發(fā)育而被動態(tài)調(diào)控的現(xiàn)象,對于理解miRNA在早期胚胎發(fā)育中的功能和機制具有重要意義。

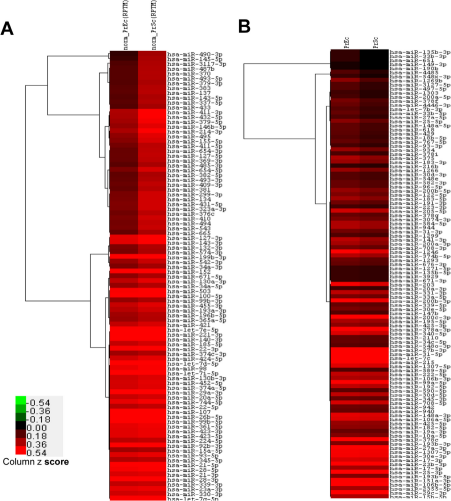
案例(2)人前列腺上皮和間質細胞小RNA深度測序展示miRNA的差異類型并首次預測靶點生長因子
本研究通過高通量測序方法對小RNA長度進行分類,繪制前列腺上皮(PrEC)和間質細胞(PrSC)miRNA圖譜。PrEC測序共得到近76M reads,其中860468條為特異性序列。PrSC測序得到近76M reads,其中1百萬條為特異性序列。鑒定得到許多高度保守及不保守的miRNA家族。與PrEC相比,16條在PrSC中顯著高表達的miRNA得到進一步分析。結果表明,這16條miRNA的靶點基因主要涉及附著連接、細胞附著、EGRF、TGF-β和雄激素信號。腫瘤抑制Let-7家族miRNA在兩株細胞中高度表達。此外,鑒定得到PrEC和PrSC細胞中特異性表達的miRNA,預測它們的作用靶點為一組轉錄因子。
參考文獻
[1] Yang et al. Highly sensitive sequencing reveals dynamic modifications and activities of small RNAs in mouse oocytes and early embryos. Science Advances, 2016.
[2] Singh et al. Deep sequencing of small RNA libraries from human prostate epithelial and stromal cells reveal distinct pattern of microRNAs primarily predicted to target growth factors. Cancer Letters, 2016.